Herzlich willkommen bei SKYRIZI®
SKYRIZI® allein oder in Kombination mit Methotrexat (MTX) wird angewendet zur Behandlung Erwachsener mit aktiver Psoriasis-Arthritis, die auf ein oder mehrere krankheitsmodifizierende Antirheumatika (DMARDs) unzureichend angesprochen oder diese nicht vertragen haben.1
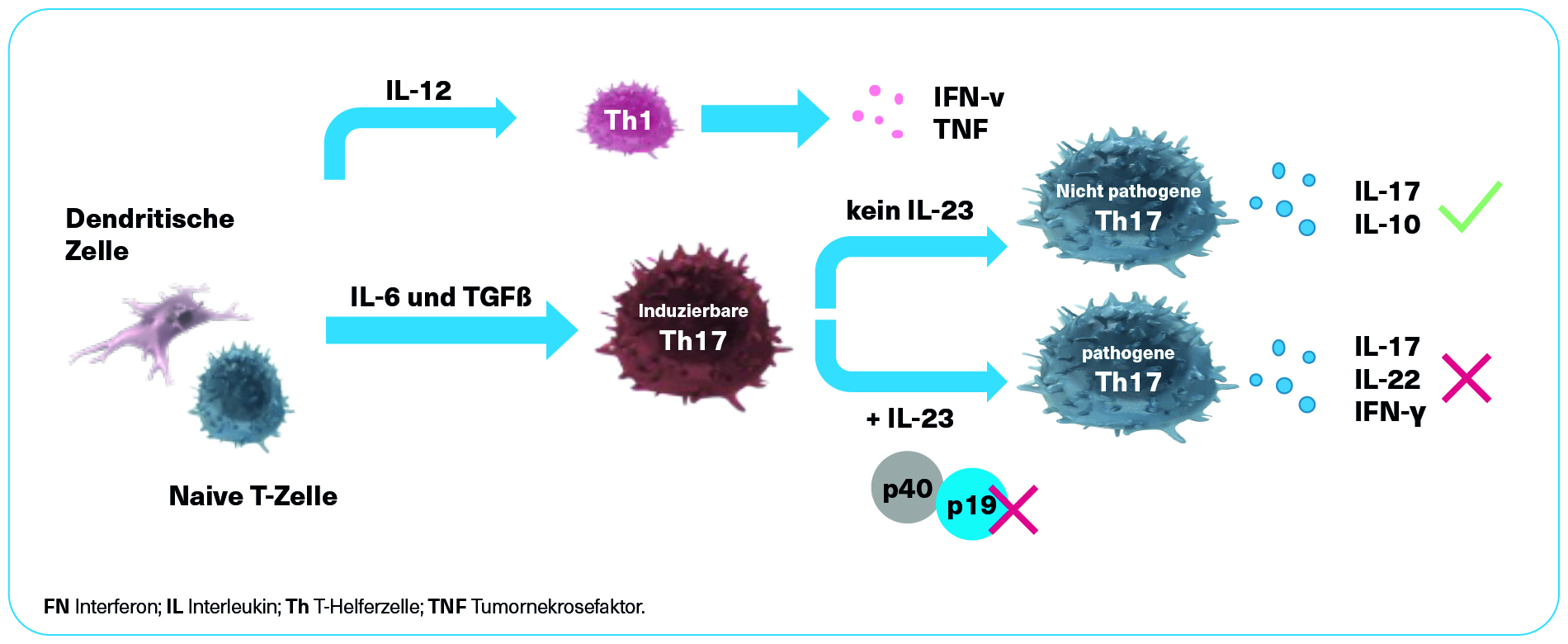
SKYRIZI® - Wirkmechanismus1,10,11
SKYRIZI® ist ein selektiver humanisierter monoklonaler Immunglobulin-G1(IgG1)-Antikörper gegen das Interleukin(IL)-23-Protein, der in Ovarialzellen des chinesischen Hamsters mittels rekombinanter DNA-Technologie hergestellt wird.1 Durch die gezielte Ausrichtung auf IL-23p19 werden nicht pathogene (protektive) Th17-Zellen erhalten.10, 11
KEEPsAKE 1 und KEEPsAKE 2
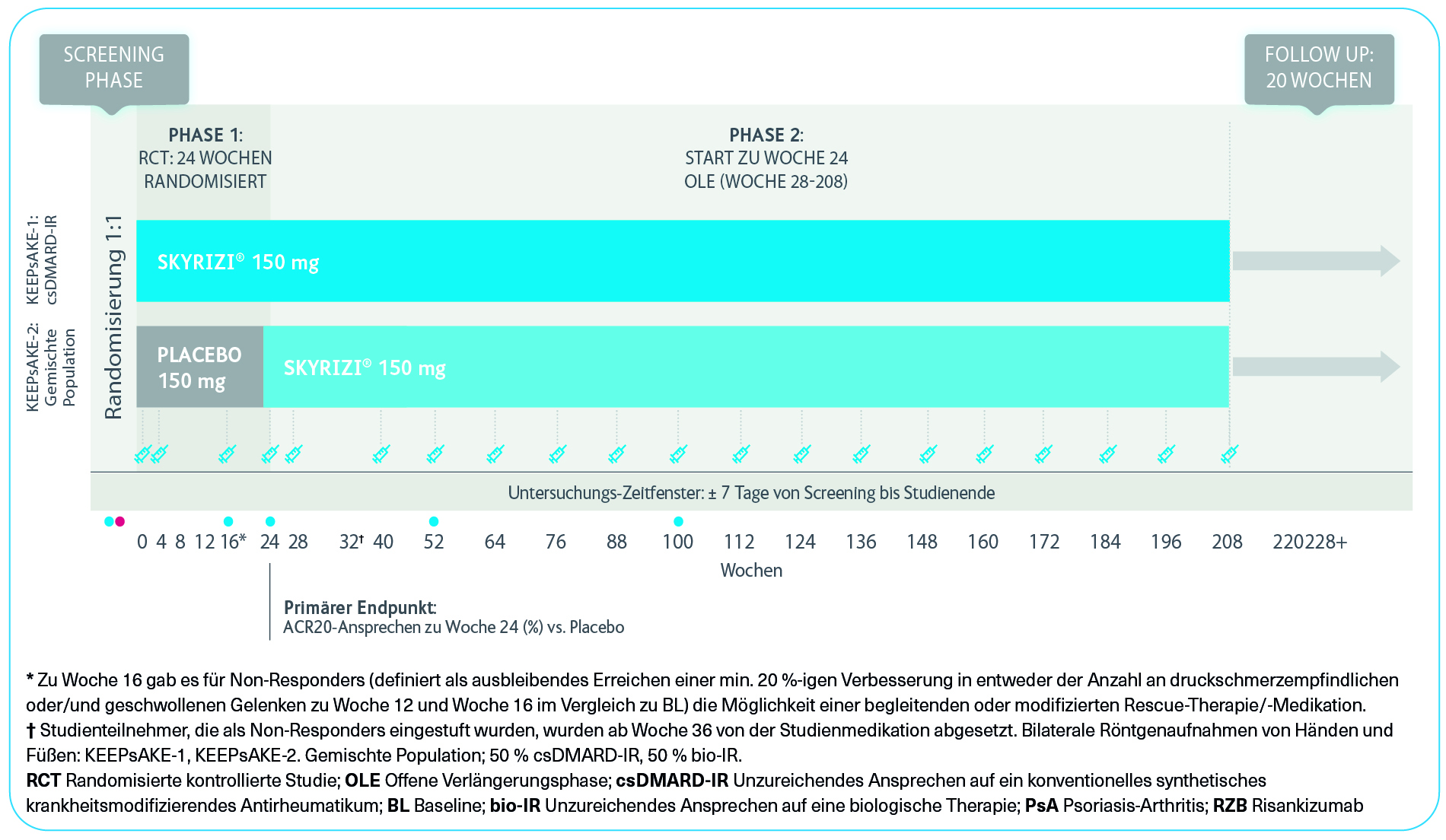
Studiendesign1,2
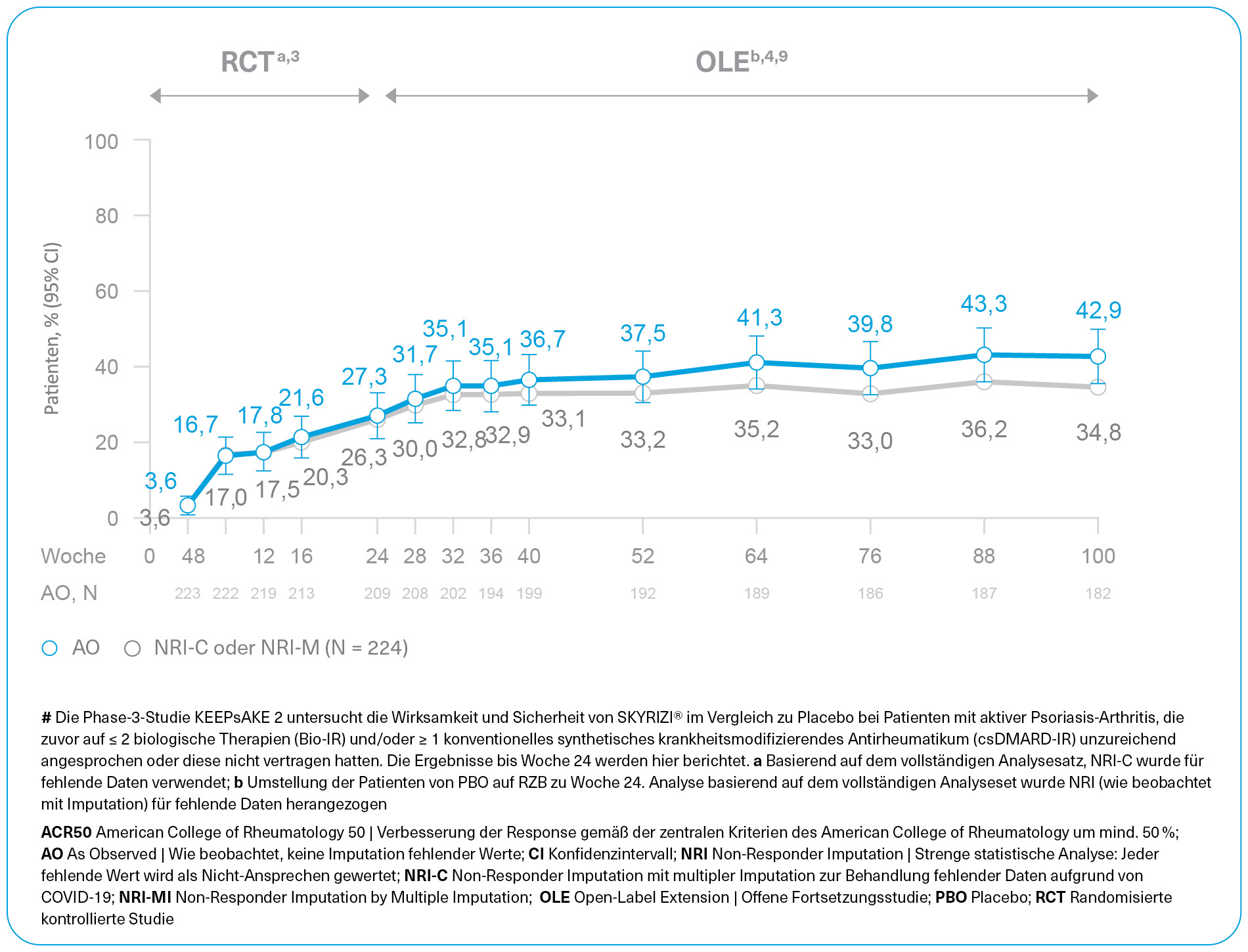
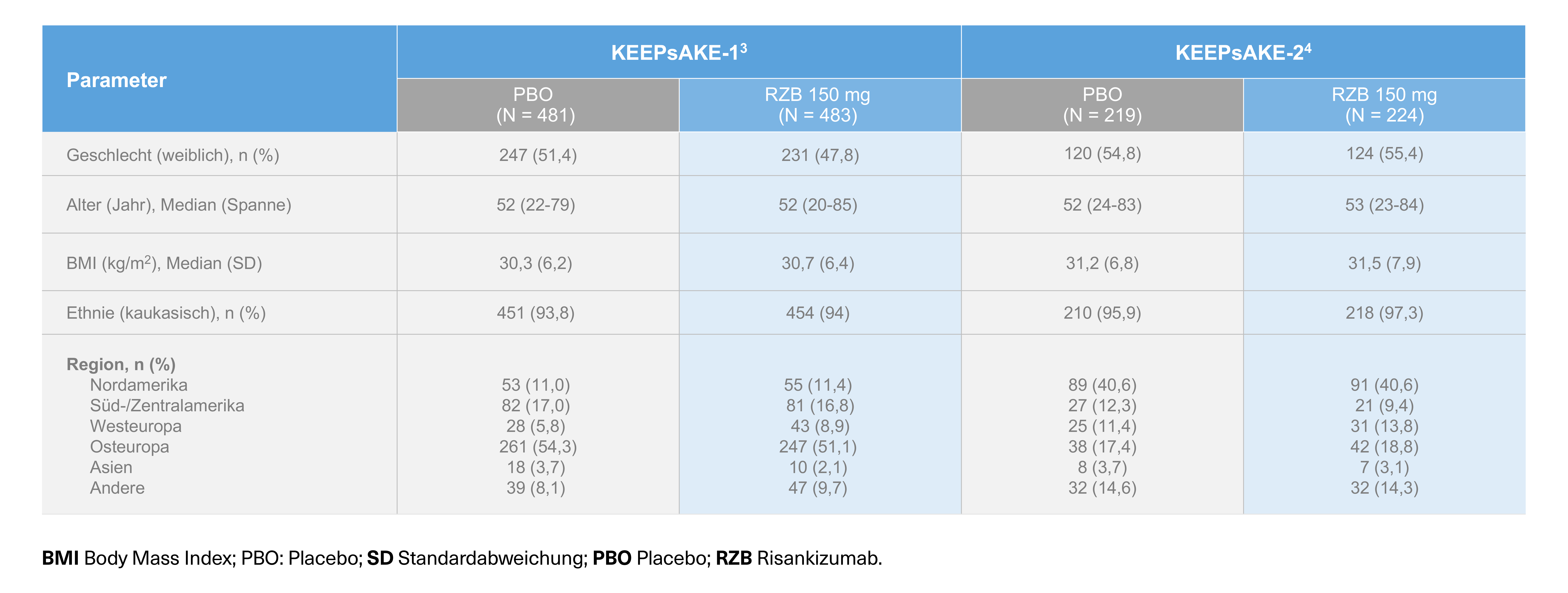
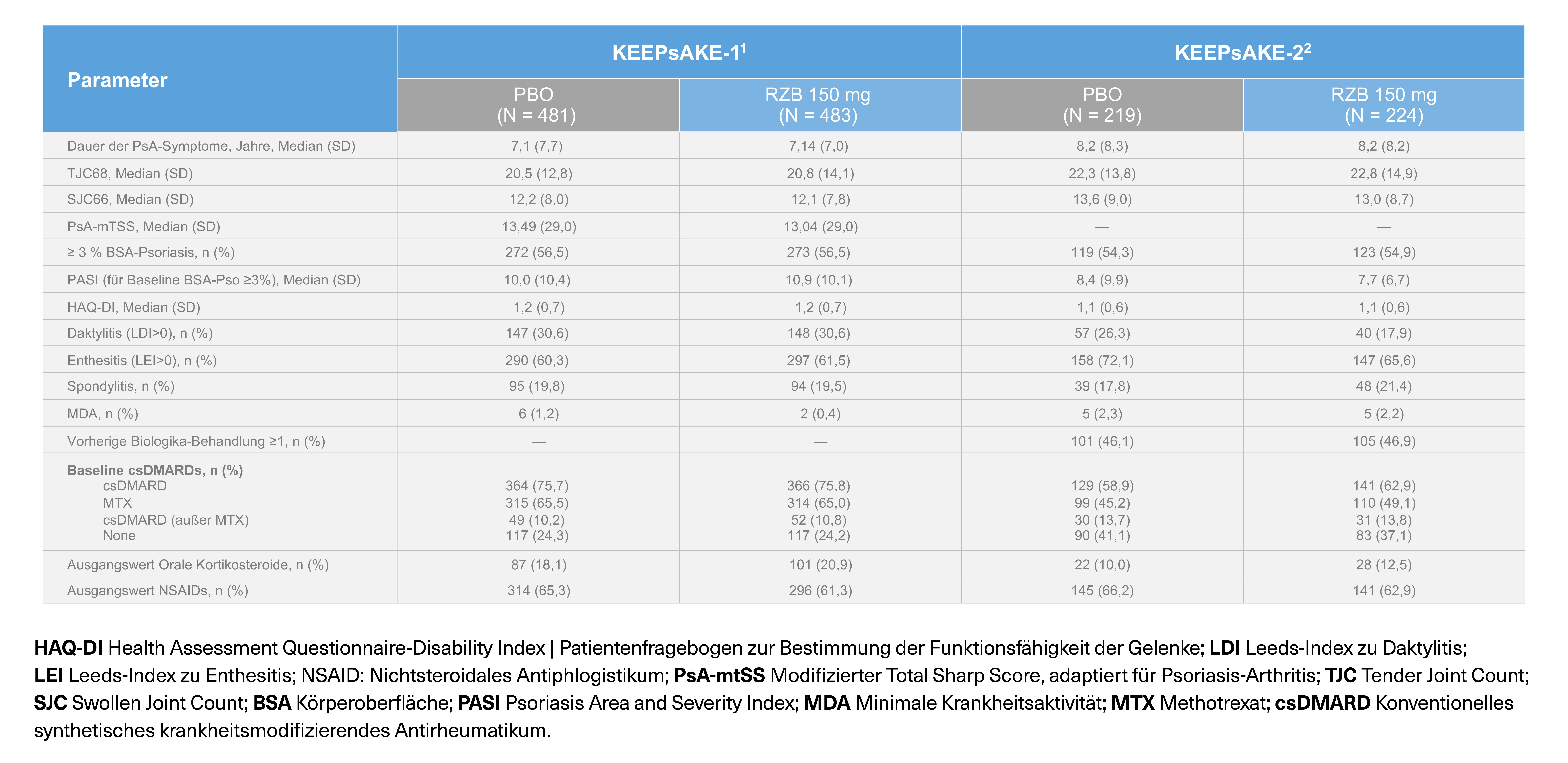
Zwei randomisierte, doppelblinde, placebokontrollierte Studien zur Untersuchung der Sicherheit und Wirksamkeit von SKYRIZI® bei 1.407 Patienten (964 in KEEPsAKE 1 und 443 in KEEPsAKE 2) ≥ 18 Jahre mit aktiver PsA.
Primärer Endpunkt: ACR20-Ansprechen zu Woche 24 (%) vs. Placebo
Gewichtete sekundäre Endpunkte: ACR20-Ansprechen zu Woche 16 (%), Auflösung der Enthesitis zu Woche 24 (%) (gepoolt), Auflösung der Daktylitis zu Woche 24 (%) (gepoolt), Minimale Krankheitsaktivität zu Woche 24 (%)
SKYRIZI® Dosierung: 150 mg in Woche 0, Woche 4 und anschließend alle 12 Wochen. Bilaterale Röntgenaufnahmen von Händen und Füßen: KEEPsAKE 1, KEEPsAKE 2. Gemischte Population; 50 % csDMARD-IR, 50 % bio-IR.
Next: KEEPsAKE 1 und KEEPsAKE 2: Einschlusskriterien
Multifaktorielle Krankheitskontrolle in der PsA
SKYRIZI® zeigt seine Wirksamkeit in allen Bereichen zu Woche 5212-14
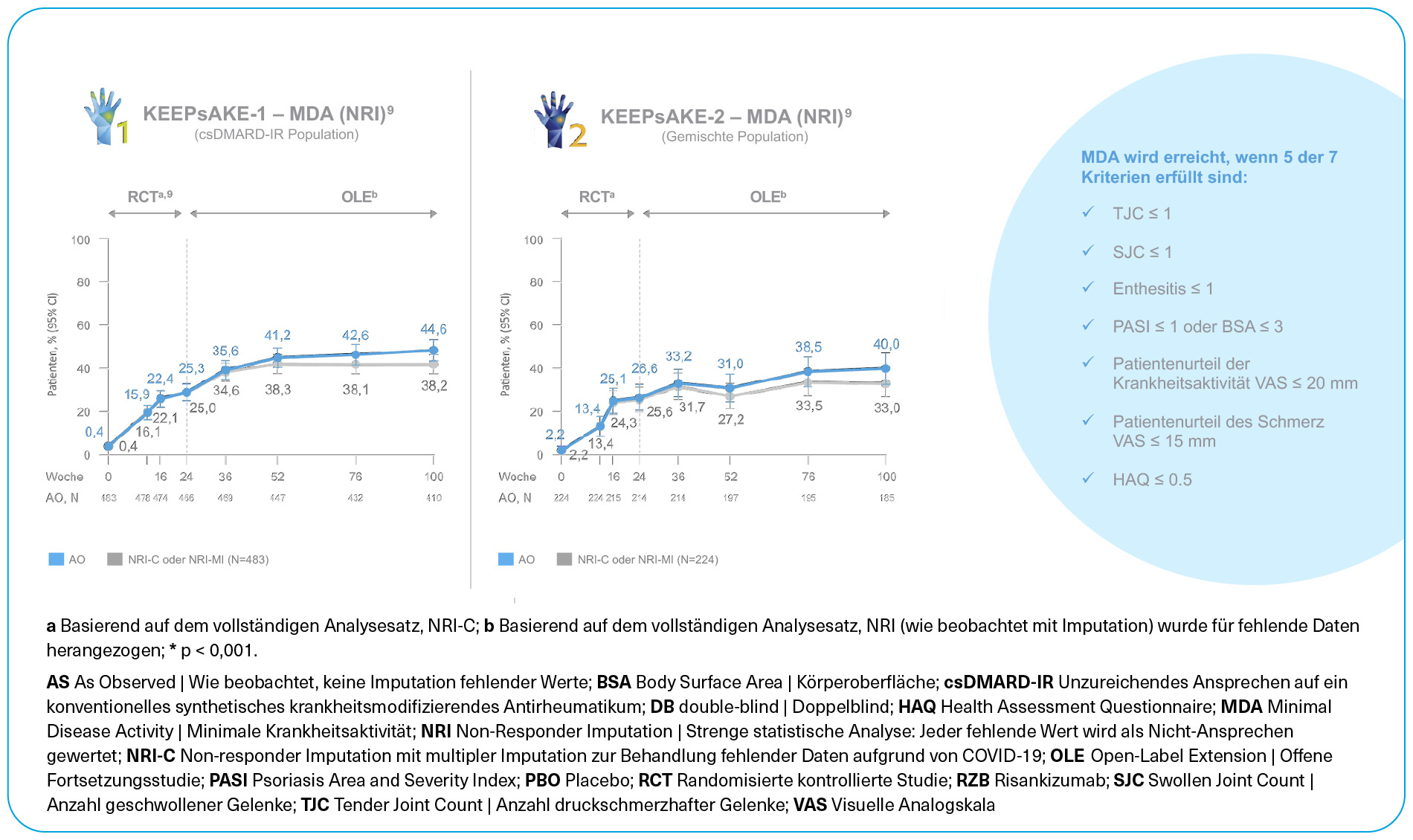
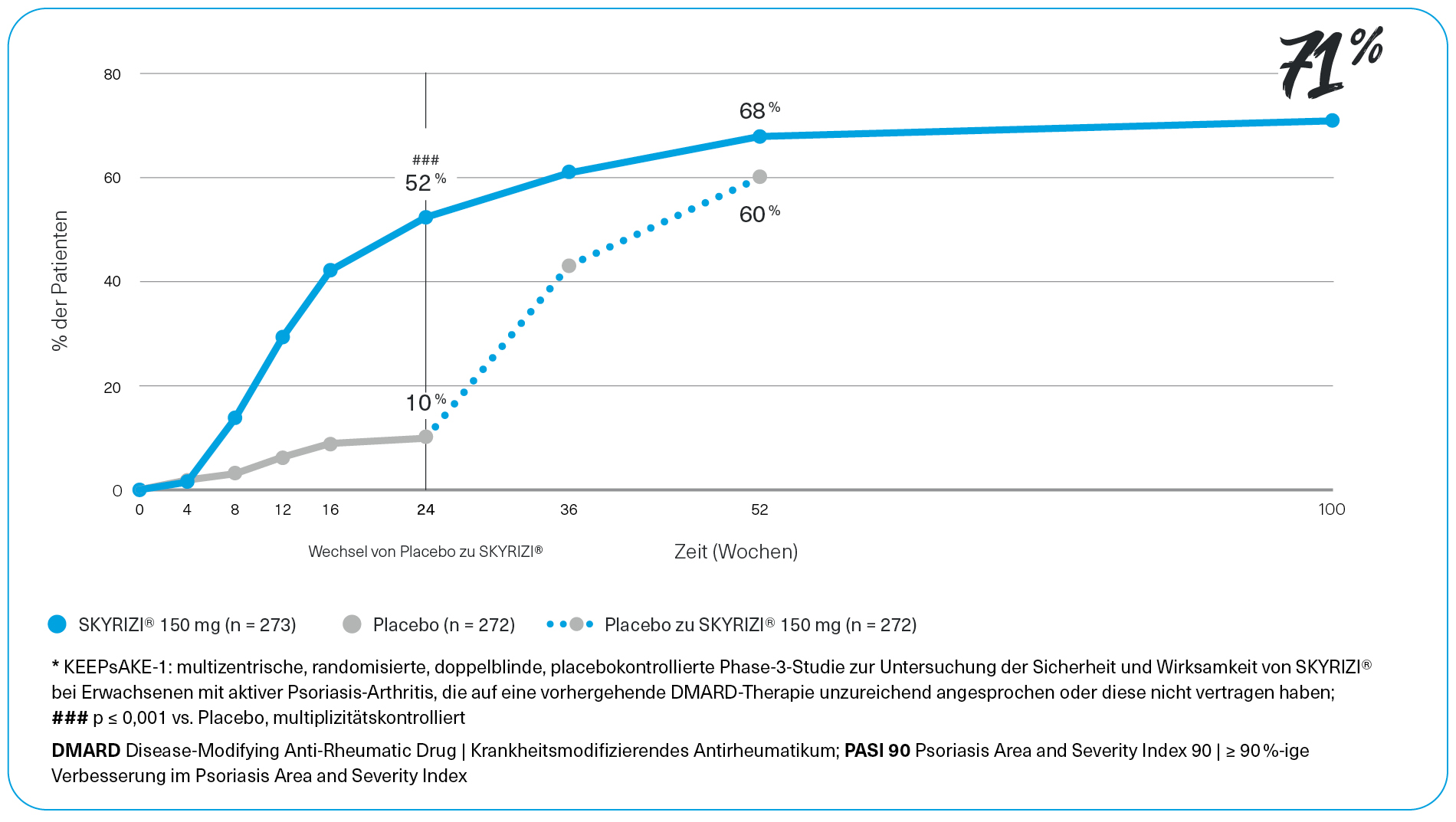
Insgesamt verbessert die Behandlung mit SKYRIZI® die verschiedenen klinischen Zeichen und Symptome der PsA, wobei die Wirksamkeit über 52 Wochen erhalten bleibt.16 SKYRIZI® wirkt multifaktoriell nach 52 Wochen Behandlungsdauer: auf die Haut mit einem Erreichen des PASI 90 bei 68 % der behandelten Patienten; auf die periphere Arthritis mit der Verbesserung der Gelenkwirksamkeit mit erreichen des ACR50 bei 43 % der Patienten; 58 % der Patienten weißen PsO-freie Nägel zur Baseline auf; bei 55 % der Patienten mit einem LEI > 0 zu Baseline Rückgang der Enthesitis; bei 76 % der Patienten ein Rückgang der Dactylitis und bei Patienten mit einer axialen Beteiligung eine durchschnittliche Veränderung des BASDAI in Woche 24 um -1,72.12-14
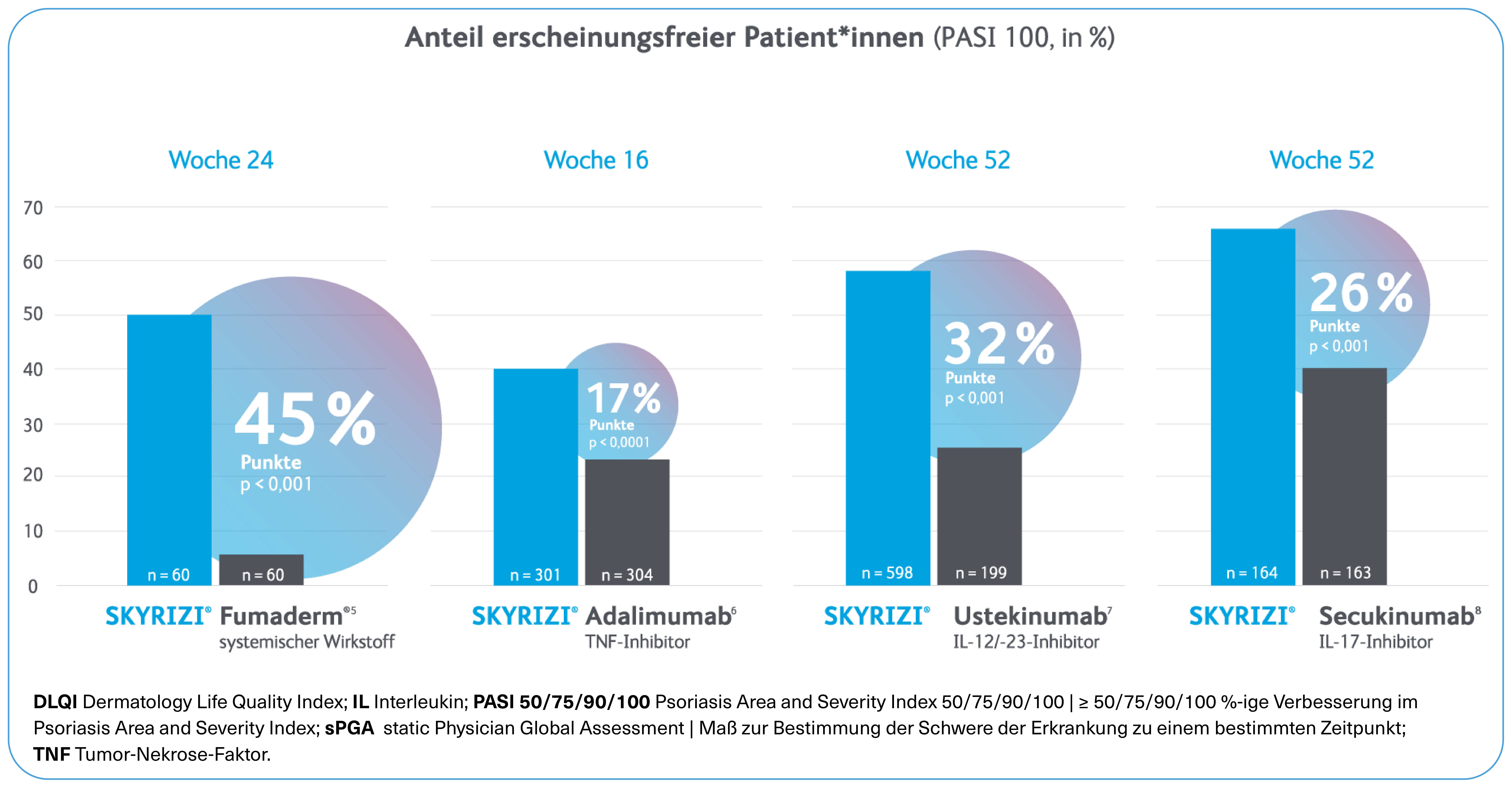
SKYRIZI® - Starke Hautwirksamkeit in der PsA
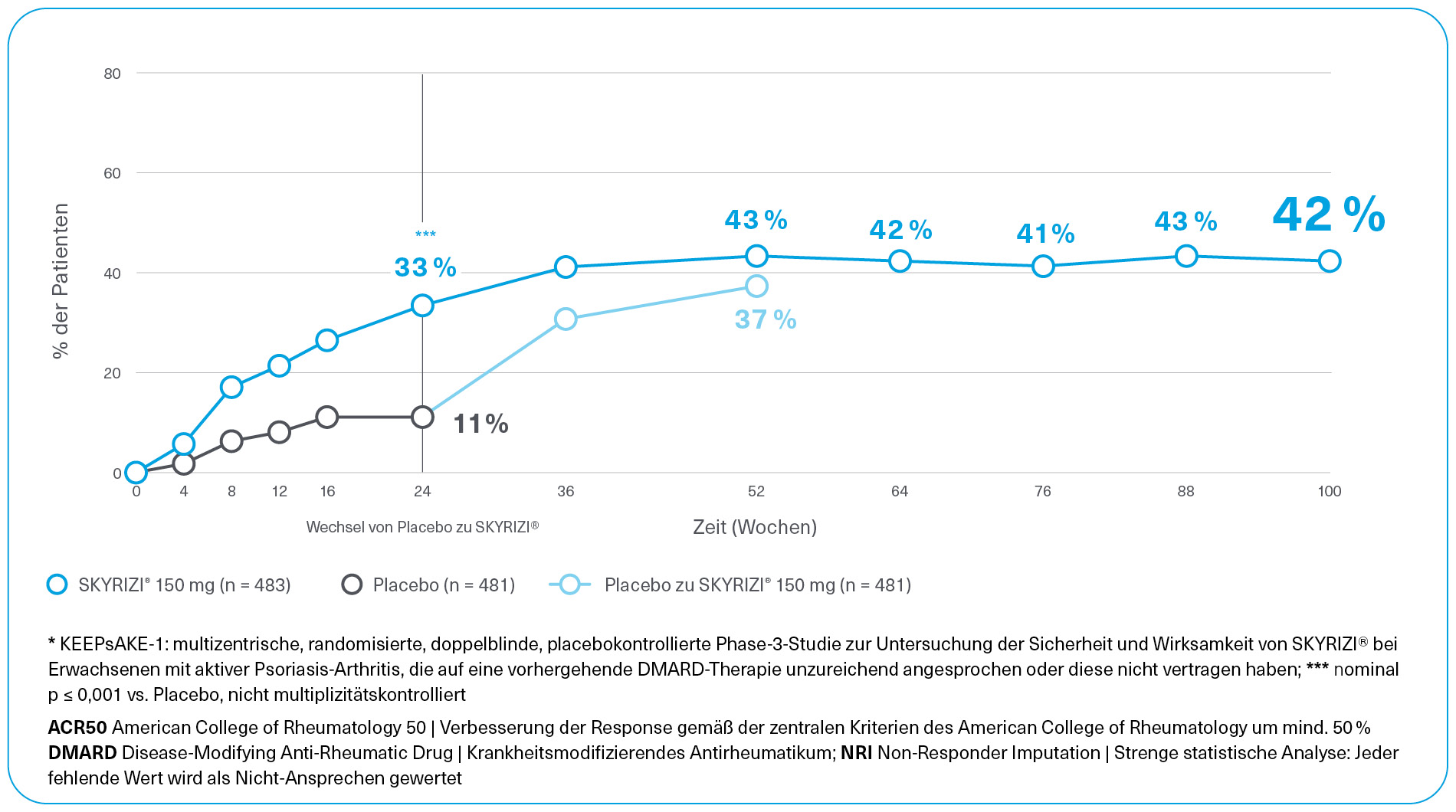
PASI 90-Ansprechen über 100 Wochen (KEEPsAKE 1; NRI)*2,3,9
KEEPsAKE 1 ist eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-3 Studie zur Untersuchung der Sicherheit und Wirksamkeit von SKYRIZI® bei Erwachsenen mit aktiver Psoriasis-Arthritis, die auf eine vorhergehende DMARD-Therapie unzureichend angesprochen oder diese nicht vertragen haben.
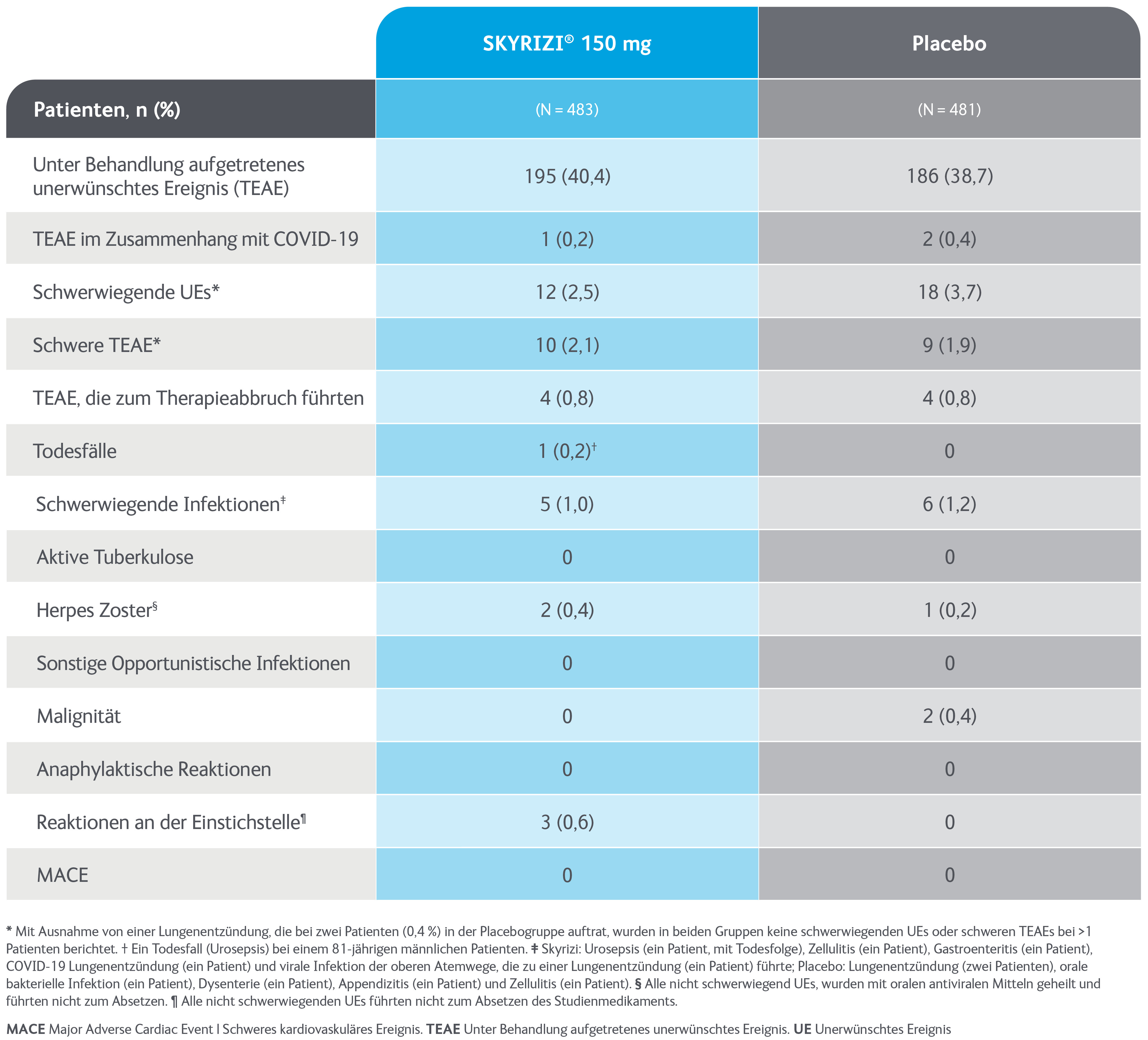
SKYRIZI® - Sicher
Sicherheitsprofil im Vergleich zu Placebo3
Referenzen
- Fachinformation SKYRIZI®, www.fachinfo.de.
- Kristensen LE et al., Virtueller EADV Kongress. 2021; D1T01.4A.
- Kristensen LE et al., Ann Rheum Dis 2022; 81:225-231.
- Östör A et al., Ann Rheum Dis. 2021; 80(Suppl 1):138–139.
- Thaçi D et al., Br. J. Dermatol. 2022; 186:30-39.
- Reich K et al., Lancet. 2019; 394(10198):576-586.
- Lebwohl M et al., Dermatol Ther (Heidelb) 2022; 12(2):407-418.
- Warren RB et al., Br J Dermatol. 2021; 184(1):50-59.
- Kristensen LE et al., Hybrider EADV Kongress 2022; D3T01.1D.
- Leung S et al., Cell Mol Immunol 2010; 7:182-189.
- Zhu J et al., Ann Rev Immunol 2010; 28:445-489 (Abbildung getreu angepasst).
- Kristensen LE et al., EULAR Kongress 2022, Poster POS1024
- Kristensen LE et al., Rheumatology. 2022; 00:1–9.
- Östör A et al., Virtueller EADV Kongress 2021, Poster P1349.
- Coates L et al., Nat Rev Rheumatol. 2022; 18(8):465-479.
- Coates L et al., Nat Rev Rheumatol. 2022; 18:465-479.



.jpg)